易基因|m6A去甲基化酶ALKBH5通过降低PHF20 mRNA甲基化抑制结直肠癌进展 | 肿瘤研究
易基因|m6A去甲基化酶ALKBH5通过降低PHF20 mRNA甲基化抑制结直肠癌进展 | 肿瘤研究
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
2022年8月17日,北京大学人民医院胃肠外科申占龙教授课题组在《Clin Transl Med》杂志发表了《N6‐methyladenosine demethylase ALKBH5 suppresses colorectal cancer progression potentially by decreasing PHF20 mRNA methylation》的研究论文,该研究通过MeRIP-seq等技术揭示ALKBH5可能通过降低PHF20 mRNA甲基化来抑制结直肠癌进展。

标题:N6‐methyladenosine demethylase ALKBH5 suppresses colorectal cancer progression potentially by decreasing PHF20 mRNA methylation
时间:2022.08.17
期刊:CLINICAL AND TRANSLATIONAL MEDICINE
影响因子:IF 8.554
技术平台:MeRIP-seq(m6A-seq)、mRNA-seq
样本:
MeRIP-seq:6个CRC患者肿瘤组织(实验组)+ 6个肿瘤附近正常组织(对照组)
RNA-seq:2个ALKBH5敲除的LOVO细胞系 + 2个对照细胞系
研究思路:

背景意义:
作为最常见的恶性肿瘤之一,结直肠癌(colorectal cancer,CRC)发病率居全球第三位,死亡率居全球第二位。尽管结直肠癌 (CRC) 的综合治疗方法有所改进,但其预后仍然很差。结直肠癌进展的分子机制有待进一步探讨。
作为最广泛的 mRNA 修饰,N6-甲基腺苷 (m6A) 受到甲基转移酶和去甲基化酶的动态可逆调节。ALKBH5 是一种主要的去甲基化酶,在癌症的进展中起着至关重要的作用。然而,ALKBH5在结直肠癌 (CRC) 中的作用和机制尚不清楚。
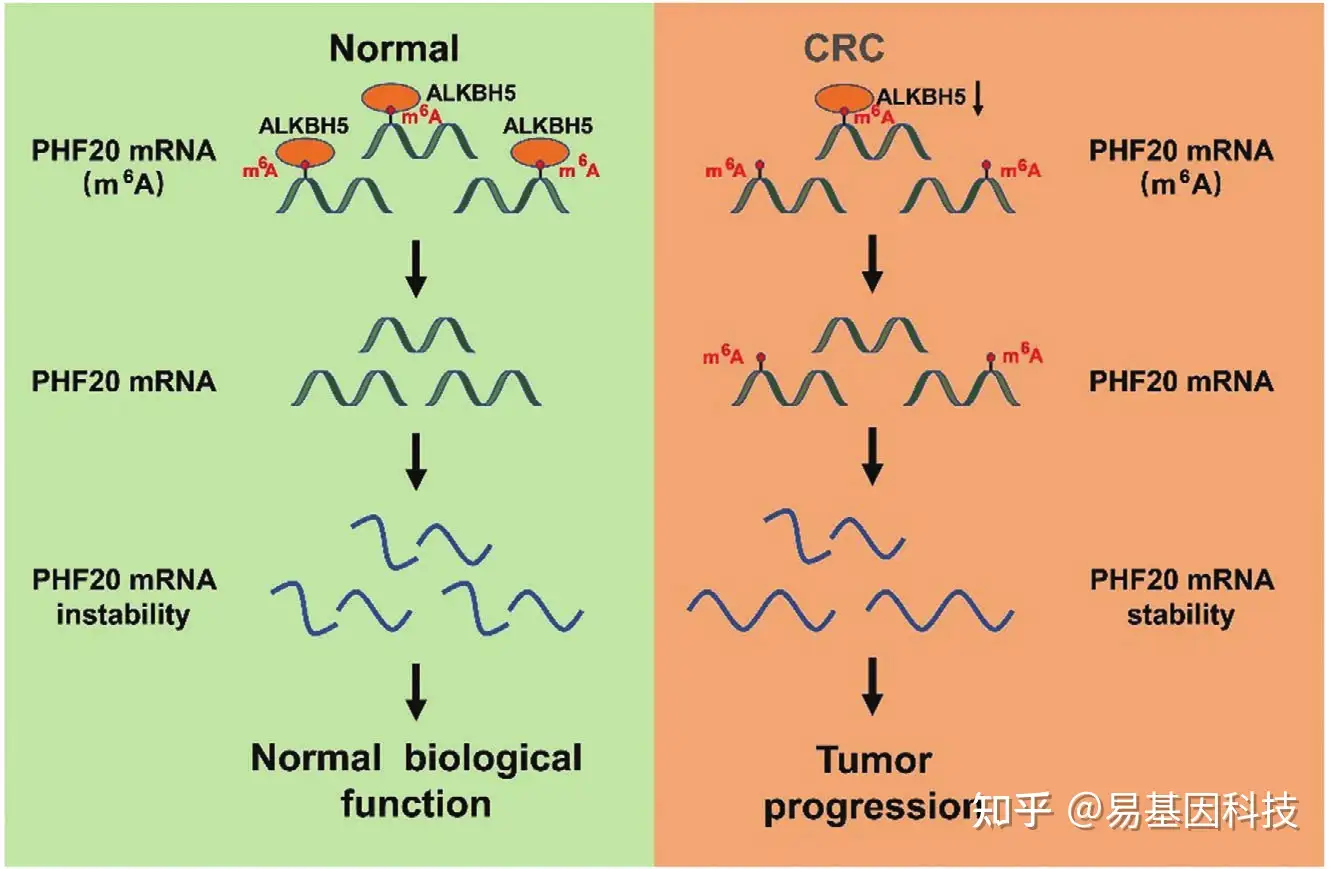
研究亮点:
(1)ALKBH5在CRC中表达下调,并发挥关键的肿瘤抑制作用。
(2)ALKBH5通过敲除m6A修饰抑制PHF20 mRNA的稳定性。
(3)靶向ALKBH5介导的PHF20 mRNA m6A修饰可能是一种有前途的CRC干预和治疗策略。
结果图形
(1)ALKBH5在CRC中表达下调
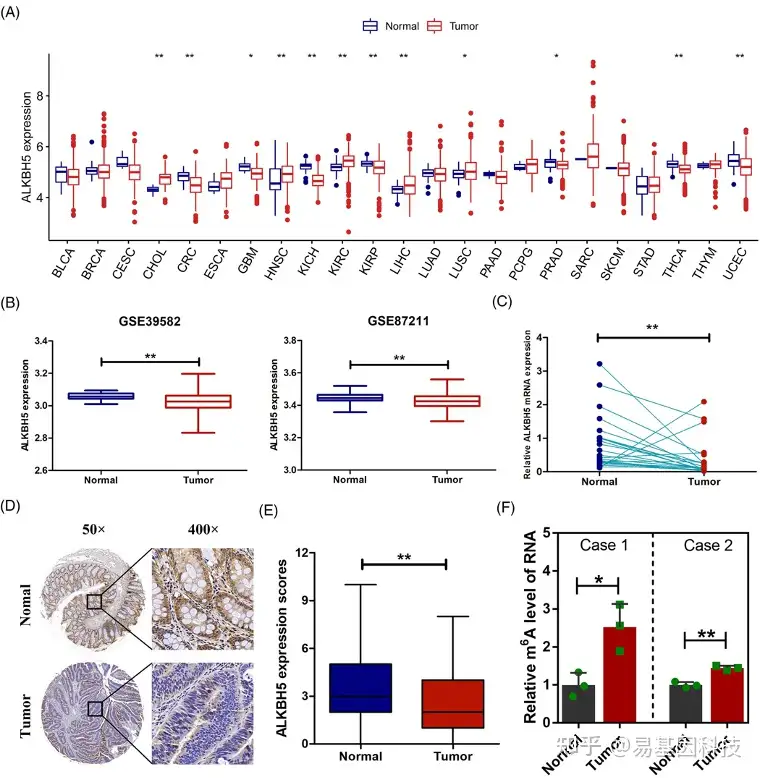
图1:ALKBH5在结直肠癌(CRC)中表达下调
- 癌症基因组图谱 (TCGA) 数据库中23种实体癌中的ALKBH5 mRNA表达。
- 基因表达综合 (GEO) 数据库中CRC的ALKBH5 mRNA 表达。
- 24 对 CRC 肿瘤和邻近正常组织中ALKBH5 mRNA 表达的RT-qPCR分析。
- CRC肿瘤和配对正常组织中 ALKBH5 表达的代表性免疫组织化学染色 (IHC) 图像。
- CRC肿瘤组织 ( n= 114) 和邻近正常组织 ( n= 107)中ALKBH5的IHC评分量化。
- CRC肿瘤组织和邻近正常组织中的N6-甲基腺苷(m6A)mRNA水平的相对定量分析。
(2)ALKBH5缺失预示CRC患者的预后更差
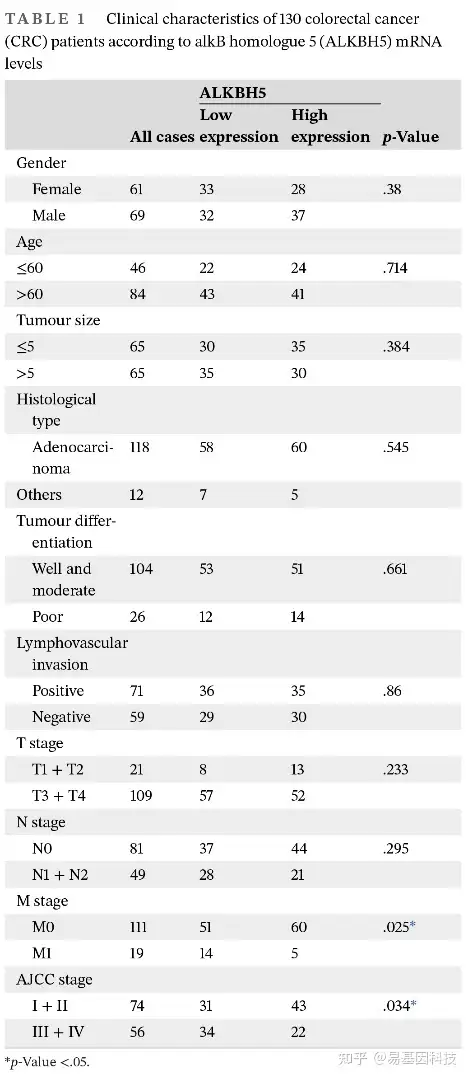
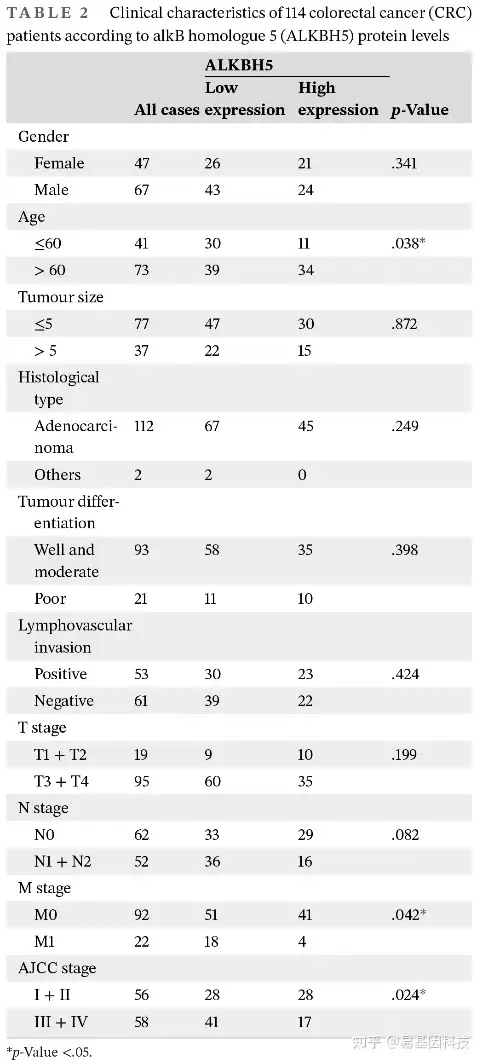
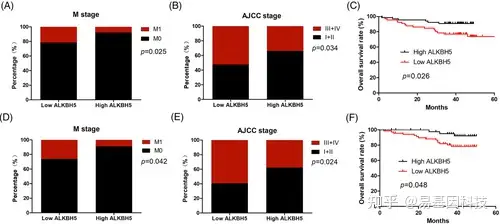
图2:ALKBH5 缺失预示CRC患者的预后更差
- ALKBH5 mRNA表达与转移 (M) 阶段之间的关系。
- ALKBH5 mRNA表达与AJCC阶段之间的关系。
- 基于ALKBH5 mRNA表达的CRC患者总生存期 (OS) 的 Kaplan-Meier 分析。
- ALKBH5蛋白表达与M期的关系。
- ALKBH5 蛋白表达与 AJCC 阶段之间的关系。
- 基于 ALKBH5 蛋白表达的CRC患者OS的 Kaplan-Meier分析。
(3)敲低ALKBH5可促进结肠癌细胞的生长和转移
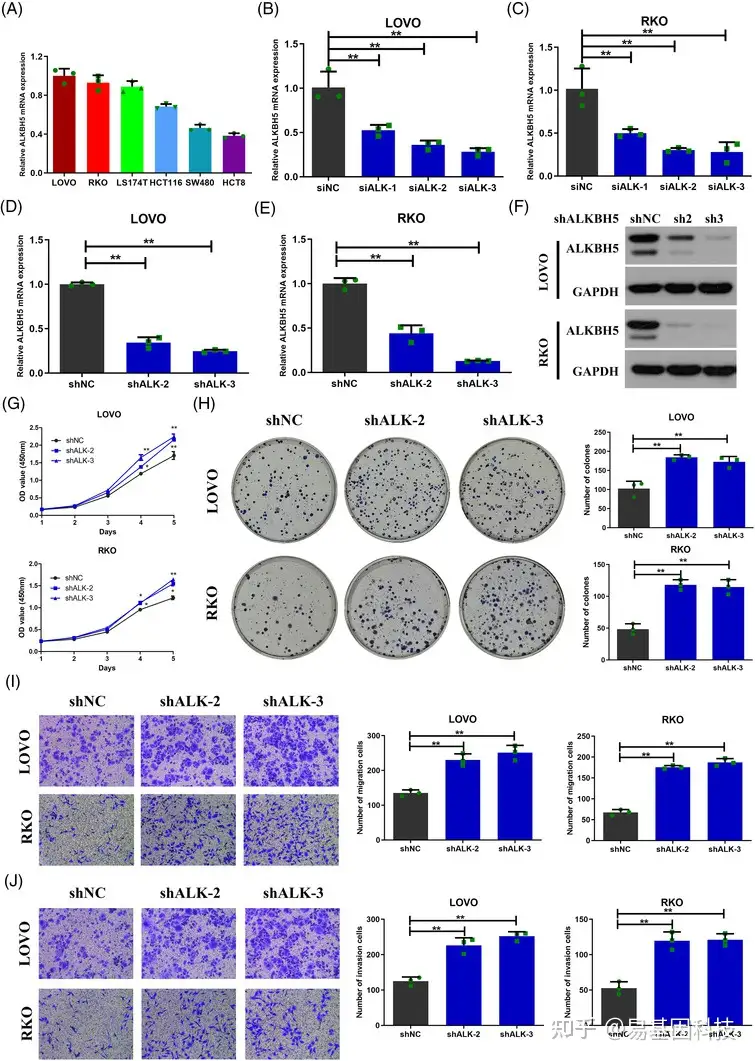
图3:敲低ALKBH5增强了体外结肠癌细胞的增殖、迁移和侵袭
- 五个结肠癌细胞中的ALKBH5 mRNA 表达。
(B 和 C) 用3种独立的靶向ALKBH5的siRNA感染的LOVO ( B )和RKO ( C )细胞系中ALKBH5 mRNA的表达。
(D 和 E) 用2种独立的ALKBH5敲低慢病毒感染的LOVO ( D )和RKO ( E )细胞系中ALKBH5 mRNA的表达。
(F) 用2种独立的 ALKBH5 敲低慢病毒感染的 LOVO 和 RKO 中的 ALKBH5 蛋白的表达。
(G 和 H) 通过 CCK8 (G) 和克隆形成 (H) 实验测定 ALKBH5 敲低的 LOVO 和 RKO 细胞系的增殖能力。
(I 和 J) 通过Transwell实验测定ALKBH5敲低的LOVO和RKO细胞系的迁移( I )和侵袭( J )能力。
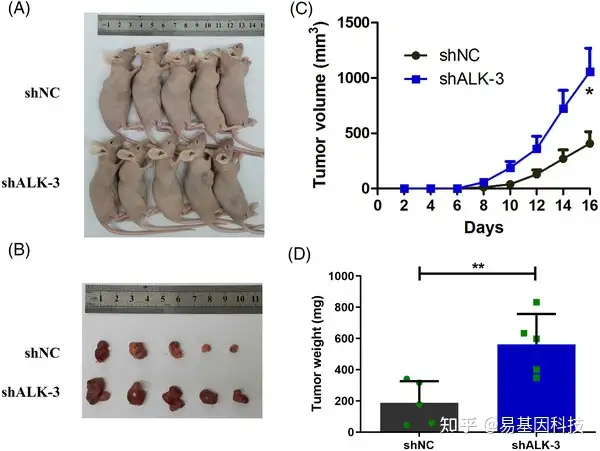
图4:敲低ALKBH5增强了体内结肠癌细胞的增殖
(A 和 B) 肿瘤异种移植模型是使用 ALKBH5 敲低的 LOVO 细胞构建的(n = 5)。
(C) 每 2 天监测一次肿瘤异种移植模型中的肿瘤形成和大小。
(D) 肿瘤重量从处死的小鼠身上测量。
(4)ALKBH5过表达抑制结肠癌细胞生长和转移
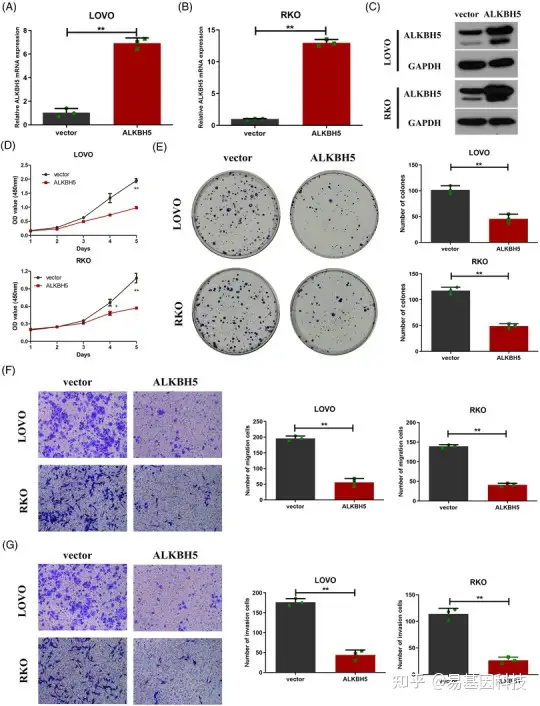
图5:ALKBH5过表达抑制体外结肠癌细胞的增殖、迁移和侵袭
(A 和 B) 用 ALKBH5 过表达或对照载体慢病毒感染的 LOVO (A) 和 RKO (B) 细胞系中的 ALKBH5 mRNA 的表达。
(C) 用 ALKBH5 过表达或对照载体慢病毒感染的 LOVO 和 RKO 细胞系中的 ALKBH5 蛋白的表达。
(D 和 E) 通过 CCK8 (D) 和克隆形成 (E) 实验测定 ALKBH5 敲低的LOVO 和 RKO 细胞系的增殖能力。
(F 和 G) 通过transwell 实验测定ALKBH5 敲低的LOVO 和 RKO 细胞系的迁移 (F) 和侵袭 (G) 能力。
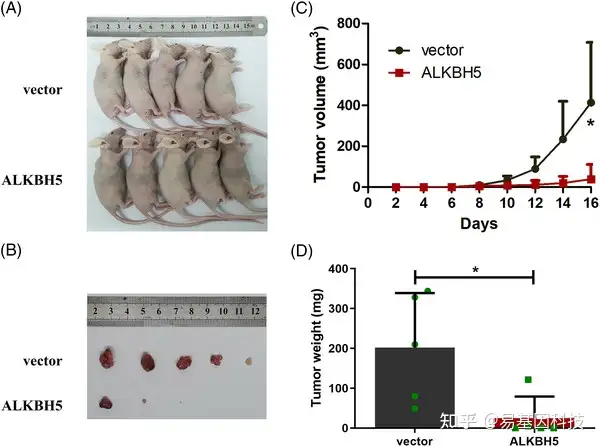
图6:ALKBH5过表达抑制体内结肠癌细胞的增殖
(A 和 B) 肿瘤异种移植模型是使用ALKBH5过表达LOVO细胞构建的( n= 5)。
(C) 每 2 天监测一次肿瘤异种移植模型中的肿瘤大小和形成。
(D) 肿瘤重量是从处死的小鼠身上测量的。
(5)ALKBH5靶向PHF20
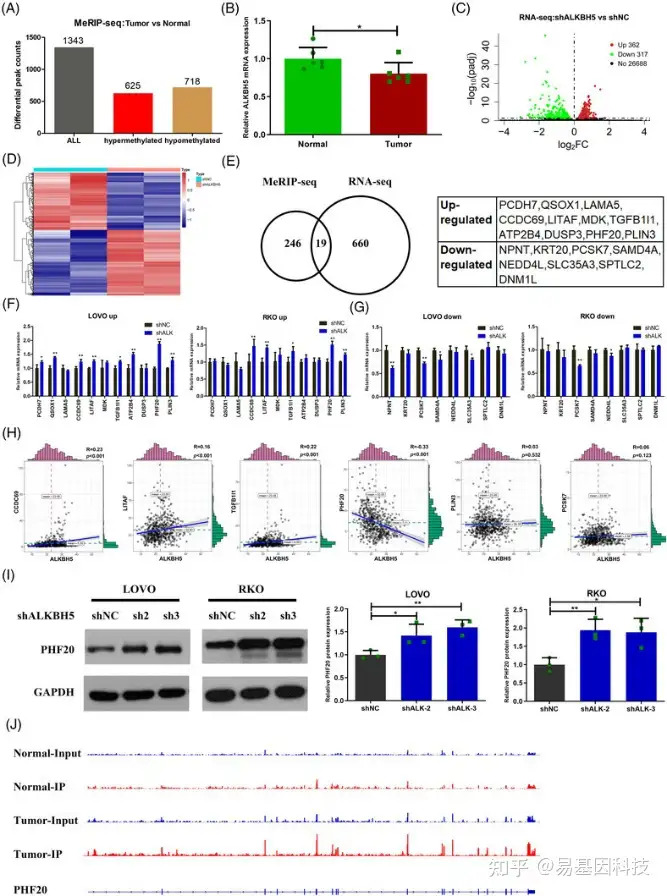
图7:PHF20是ALKBH5介导的m6A修饰的下游靶点
- 肿瘤组织和肿瘤邻近正常组织的 MeRIP-seq 结果显示了6名结直肠癌 (CRC) 患者中变化的m6A peak分布。
- 六对肿瘤组织和肿瘤邻近正常组织中的 ALKBH5 mRNA 的表达。
(C 和 D) RNA-seq 中ALKBH5 敲低细胞系与对照细胞系的差异表达基因火山图(C)和热图(D)。
(E) MeRIP-seq 和 RNA-seq 数据的联合分析。
(F) 与对照组相比,ALKBH5 敲低细胞系中上调基因的验证。
(G) 与对照组相比,ALKBH5 敲低细胞系中下调基因的验证。
(H) ALKBH5 与癌症基因组图谱 (TCGA) 数据库中的六个候选基因(CCDC69、LITAF、TGFB1I1、PHF20、PLIN3和PCSK7 )之间的关系。
- PHF20 在 ALKBH5 敲低细胞系和对照细胞系中的蛋白表达。
(J) CRC中的PHF20 mRNA的代表性m6A peak。
(6)ALKBH5缺失增强PHF20 mRNA的稳定性以促进CRC进展
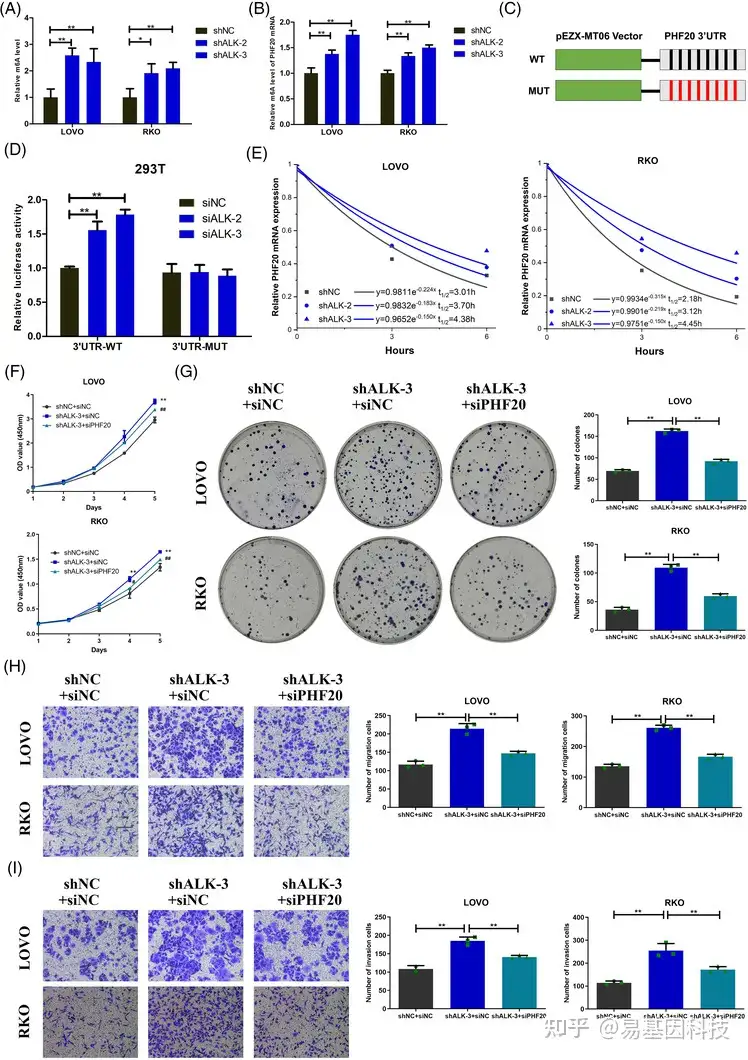
图8:ALKBH5通过降低PHF20mRNA甲基化来抑制结直肠癌(CRC)进展
- ALKBH5 敲低细胞系和对照细胞系中mRNA 的整体m6A水平的相对定量分析。
- MeRIP-qPCR 分析ALKBH5 敲低细胞系和对照细胞系中 PHF20 mRNA的m6A 水平的变化。
- 包含m6A motif或m6A突变(A–T突变)位点的人类 PHF20 3'UTR的荧光素酶报告载体构建。黑色代表A,红色代表 T。
- 共转染含有野生型或突变型PHF20 3'UTR的质粒和含有siNC或siALKBH5的siRNA的293T细胞系的相对荧光素酶活性。
- RT‐qPCR分析ALKBH5被抑制后,放线菌素D ( 5μg / ml )处理LOVO或RKO细胞系后PHF20 mRNA的衰减率。
- –(I) 挽救实验用于确定ALKBH5是否通过调节PHF20对LOVO和RKO细胞系的增殖(F和G)、迁移(H)和侵袭(I)产生影响。
结论:
本研究利用MeRIP-seq和RNA-seq技术,确定了ALKBH5表达在CRC中下调,同时其发挥重要的肿瘤抑制作用。从机制上讲,ALKBH5通过去除m6A修饰来抑制PHF20 mRNA的稳定性。该研究为ALKBH5介导的m6A修饰的抗癌作用提供了新的见解,同时也表明了靶向PHF20 mRNA的ALKBH5介导的m6A修饰可能是干预和治疗CRC的一个有希望的策略。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
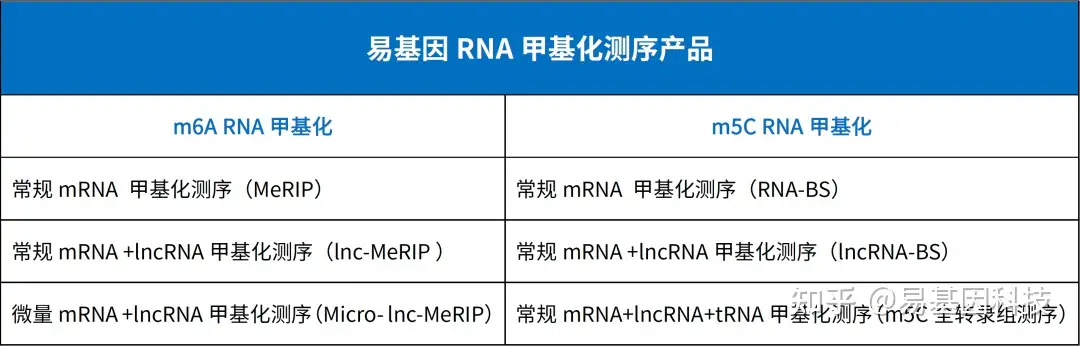
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
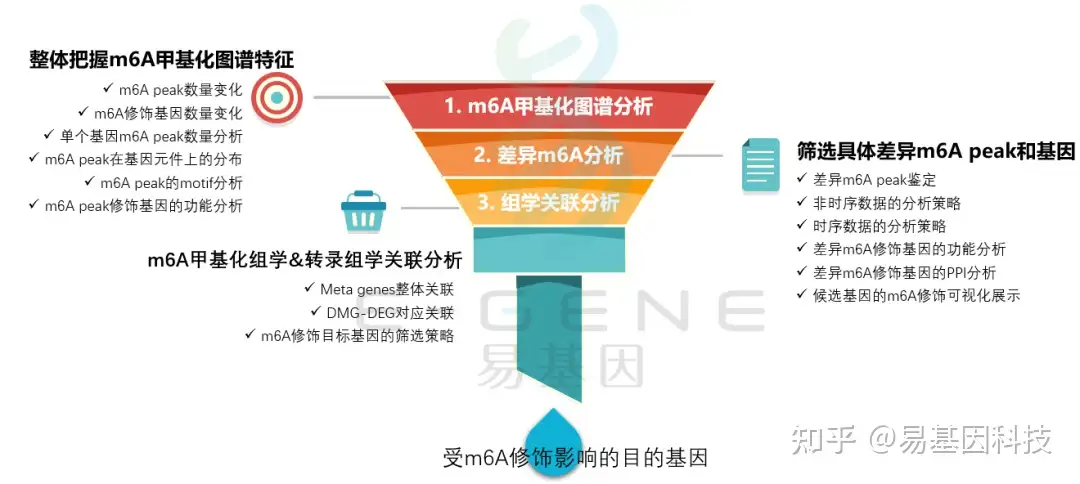
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
参考文献:
Zhang Z, Wang L, Zhao L, Wang Q, Yang C, Zhang M, Wang B, Jiang K, Ye Y, Wang S, Shen Z. N6-methyladenosine demethylase ALKBH5 suppresses colorectal cancer progression potentially by decreasing PHF20 mRNA methylation. Clin Transl Med. 2022 Aug;12(8):e940.
相关阅读:
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
技术推介|RNA m⁶A甲基化测序(MeRIP-seq)技术介绍
m6A去甲基化酶ALKBH5通过降低PHF20 mRNA甲基化抑制结直肠癌进展 | 肿瘤研究




