易基因|DNA-蛋白质互作的检测技术及ChIP-seq实验关键 | 易讲堂
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
蛋白质-DNA互作是基因转录调控的关键,也是启动基因转录的前提。蛋白质与DNA互作主要包括组蛋白、转录因子、DNA甲基化酶和染色质重塑复合物等。为研究蛋白质-DNA互作,科学家发明了很多方法:凝胶阻滞、DNaseⅠ足迹实验、甲基化干扰、体内足迹、酵母杂交、ChIP-Seq等。其中ChIP-Seq可以真实、完整地反映结合在DNA序列上的靶蛋白,是目前研究蛋白质-DNA互作的经典方法。
一、DNA-蛋白质互作——染色质状态和功能研究
在生物学研究中,DNA与蛋白质之间的互作(DNA-Protein Interactions,DPIs)是至关重要的,参与基因的表达、调控、复制、重组和修复以及RNA的转运、翻译和调控等多个过程,几乎涉及所有的生命活动。
DNA结合蛋白是普遍存在的,在高等动植物中平均占蛋白/基因种类的10%(约2000个)。染色质/DNA与蛋白质结合影响转录调控。
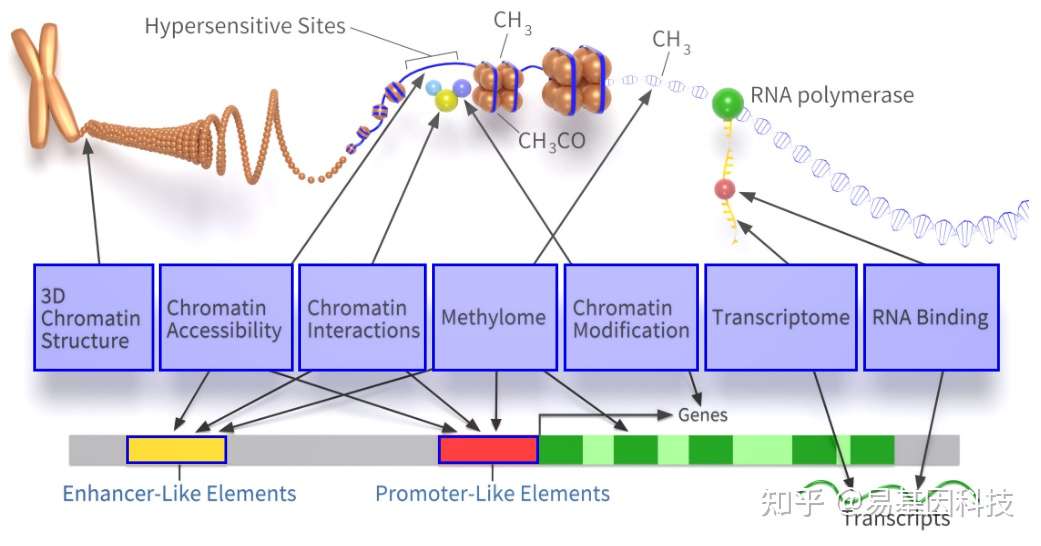
二、DNA-蛋白质互作(DPIs)主要研究的蛋白靶标类型
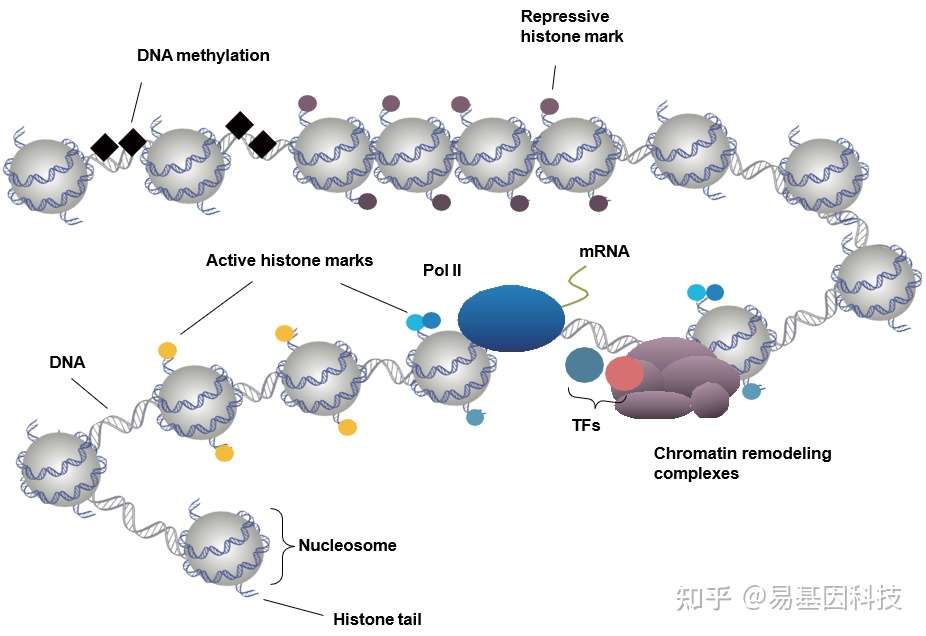
(1)组蛋白修饰
- 与DNA结合非常紧密
- 每个含有DNA片段含有多个组蛋白信号
- 实验相对简单
(2)DNA 结合的转录因子
- DNA结合不如组蛋白紧密
- 每个DNA片段含的TF较少
- 实验更复杂
(3)转录辅因子
- 通常不是直接和DNA结合,因而难以交联固定
- 通常是大蛋白复合体中的一个成分,抗原表位容易被掩蔽
- 实验难度比较大
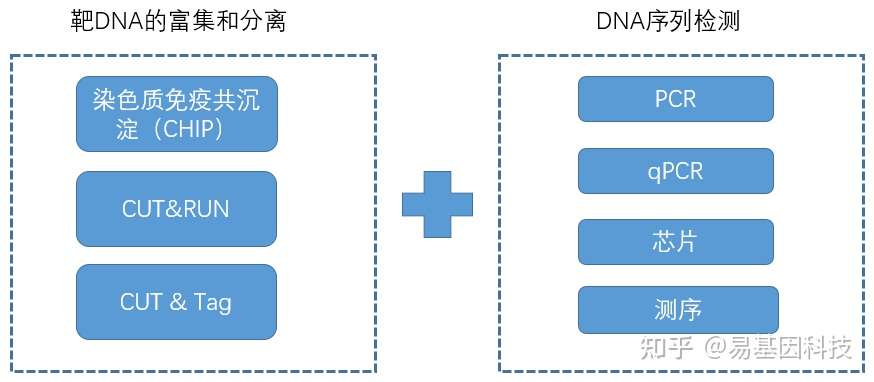
三、DNA-蛋白质互作(DPIs)的主要研究技术手段
传统技术:凝胶阻滞实验(Gel-shift assy)、足迹实验(Foot-printing assy)
现代技术
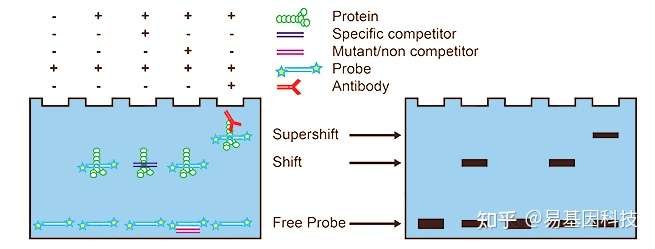
(1)凝胶阻滞实验(定性)
凝胶阻滞或电泳迁移率实验(Electrophoretic mobility shift assay,EMSA),是一种研究DNA结合蛋白质和相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
原理:基于DNA-蛋白质或RNA-蛋白质复合体在聚丙烯酰胺凝胶电泳(PAGE)中有不同迁移率,当蛋白质与特异的DNA或RNA结合后,其在PAGE中的迁移率将小于未结合核蛋白质的DNA,从而检测到蛋白与DNA或RNA结合的阻滞条带。
竞争DNA:与探针DNA结合的是同种蛋白,但是被极大超量加入
(2)足迹实验(定性)
DNase I足迹分析实验(DNase I footprinting assay)可以精确鉴定其结合的DNA序列,从而帮助我们研究基因转录调控的机制。
原理:蛋白质结合在DNA片段上,能保护结合部位不被DNase破坏,DNA分子经酶切作用后遗留下该片段(亦称"足迹"),进而可以确定它的序列。在电泳凝胶的放射性自显影图片上,相应于蛋白质结合的部位没有放射性标记条带。
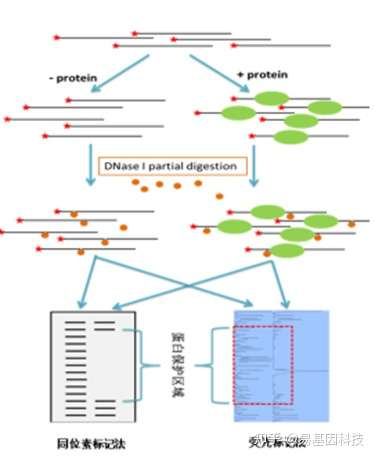
(3)染色质免疫共沉淀(ChIP)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是一种用来在体内鉴定及分析基因组内部蛋白质-DNA 相互作用的有力研究技术。
原理:利用抗体抗原反应,通过对应抗体将与DNA结合蛋白发生互作的DNA分子沉淀下来,然后进行定性定量。
应用:ChIP 用来在空间上和时间上沿基因或基因组定位:
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
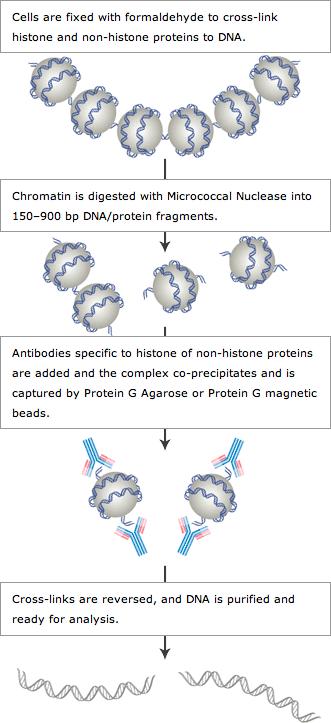
四、最常用的DPIs高通量测序技术——ChIP-seq
在ChIP的基础上,用二代测序检测ChIP实验的DNA产物,将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
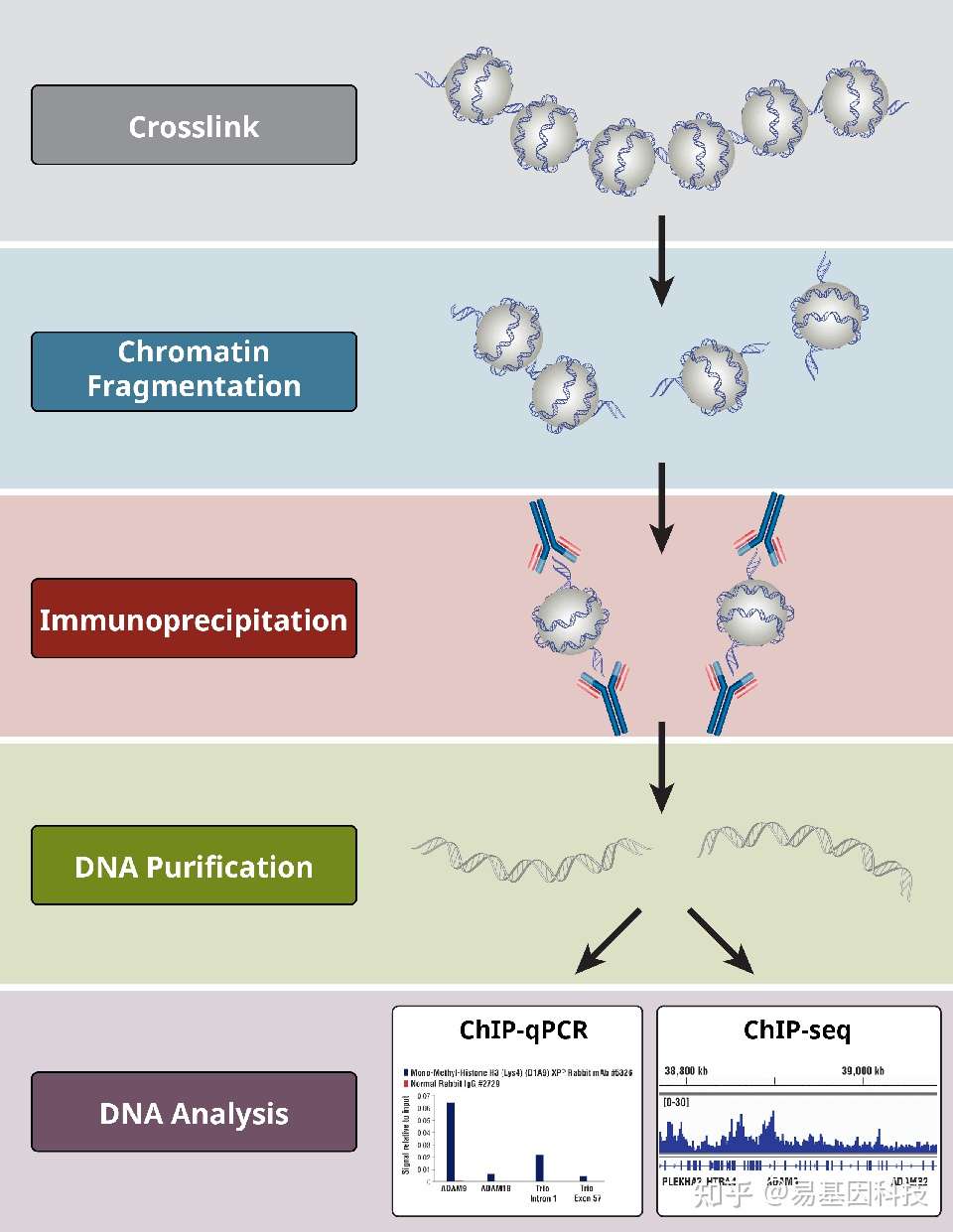
(1)CHIP-seq的主要技术类型
① 交联染色质免疫沉淀的 ChIP 方案 (crosslinking/X-ChIP)
- 采用甲醛交联,固定DNA与蛋白的结合
- 结合稳固,不易脱落(可研究转录因子结合)
- 存在表位掩蔽
- 是CHIP-seq的主流方案
② 自然染色质免疫沉淀方案 (native/N-ChIP)
- 采用微球菌核酸酶(MNase)裂解染色质以获取DNA片段(一般会得到147bp左右的片段)
- 自然结合,松散,容易失去联系(一般用于组蛋白修饰)
- 不存在表位掩蔽
- 是X-CHIP表位掩蔽严重时的备选方案
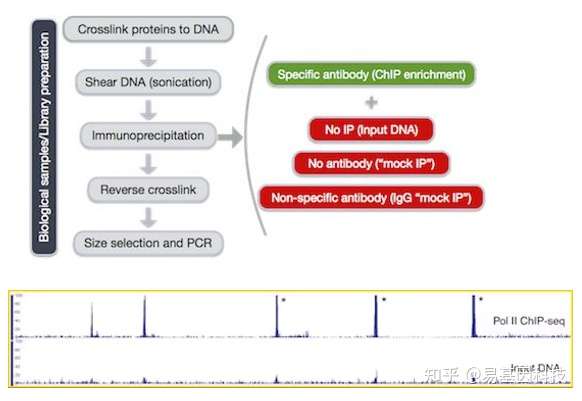
(2)CHIP-seq实验设计——偏差来源与对照样本的设置
ChIP-Seq富集序列存在以下特点:
- 开放染色质区域比紧密区域更易打断
- 重复序列会似乎出现被富集的现象
- 序列在整个基因组上不均匀分布
因此,ChIP-Seq需要有合适的对照组,对照样本需要满足以下其中一个条件:
- Input对照: 【少了加抗体的步骤】
- mock IP对照:【步骤一样但没有用抗体】
- IgG mock IP对照:【步骤一样但换了抗体】
(3)CHIP-seq的主要限制
- 时间约3天
- 由于低效的IP步骤,需要数以百万计的细胞起始
- 在低丰度细胞类型上执行具有挑战性
- 染色质的交联可能引起抗原表位掩蔽,也会导致非特异性信号
- 过度交联会引起DNA片段化不足
- 可重复性差
- 低信噪比,具有高的背景信号
(4)CHIP-seq实验成功的关键问题
① 抗体质量
ChIP-seq是基于抗体的免疫沉淀实验,因此它的数据质量好坏直接取决于抗体的质量和特异性。
另外,针对同一蛋白的不同抗体,可能会识别不同的表位(尤其是单克隆抗体)。因此建议针对同一感兴趣蛋白测试不同的抗体,通过Western blot检测knock-down前后的差异帮助选择。
② 测序数据量
为了捕获所有真实的结合位点,而我们看不见摸不着,只能通过测序的reads去计算来帮助判断,因此测序reads的数量是一个决定因素。
需要多少reads呢?
这个取决于基因组的大小和感兴趣因子的结合方式(sharp regions for TFs and broad regions for histone marks)。哺乳动物中,鉴定TFs至少要满足30M,broad histone marks至少要60M,input对照要和ChIP样本保持同样测序深度。reads数量还取决于抗体质量和免疫沉淀的效率。信噪比越高,需要的reads数可以适当减少。
③ 生物学重复
样本重复可以看到实验设计的好坏,选择相关性高的样本进行后续分析
推荐三个生物重复,但两个现在也能接受(最粗略的实验设计就是:每个ChIP样本2个重复,input只有一个没有重复)
如果样本间的本质差异越大,越需要设置重复,例如从不同人取的样本。
五、DNA-蛋白质互作高通量测序ChIP-seq项目文章:
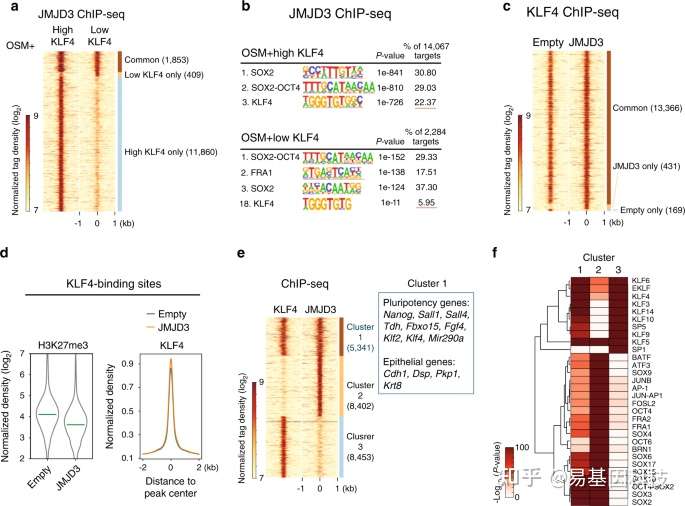
Huang Y,et al.JMJD3 acts in tandem with KLF4 to facilitate reprogramming to pluripotency. Nat Commun. 2020 Oct 8;11(1):5061. ChIP-seq揭示H3K27me3去甲基化酶在体细胞重编程调控转录机制
1、背景
作为个体发育和干细胞分化中最重要的组蛋白修饰之一,H3K27me3标记发育分化基因并抑制其表达,在基因组水平H3K27me3的动态变化是发育和分化得以有序进行的重要基础。体细胞重编程是发育和分化的逆向过程,H3K27me3势必经历逆向的时空变化。
2、方法
将小鼠饲养在病原体的环境中,12小时光照/黑暗循环,温度保持22-24°C,相对湿度40–70%,吸入二氧化碳进行安乐死,提取样本对体细胞重编程,进行RNA-seq、ATAC-seq和ChIP-seq等测序分析。
3、结论
作者通过对小鼠体细胞重编程过程中进行转录组和ChIP-seq等测序分析,揭示了H3K27me3去甲基化酶JMJD3与KLF4在体细胞重编程中协同调控转录新机制。首先,JMJD3对重编程有2方面相反的作用;在机制上,JMJD3被KLF4特异性地招募至上皮和多能性基因位点,并辅助KLF4激活这些基因。进一步,作者还在多种其他KLF4介导的细胞命运转变中验证了JMJD3的这一作用模式。
参考文献:
Huang Y,et al.JMJD3 acts in tandem with KLF4 to facilitate reprogramming to pluripotency. Nat Commun. 2020 Oct 8;11(1):5061.
Adapted from Bruneau, B.G. (2010) Circulation Research 107:324-326
更多阅读:
项目文章|ChIP-seq揭示H3K27me3去甲基化酶在体细胞重编程调控转录机制


