玻璃的定义:玻璃是熔融、冷却、固化的非结晶(在特定条件下也可能成晶体)无机物。
玻璃的性质:透明、坚硬、耐蚀、耐热和电学、光学性质;成型和加工方法多样,调整组成改变其质。
玻璃的分类:
日用玻璃:包括瓶罐、器皿、保温瓶、工艺美术品。
建筑玻璃:窗玻璃、平板玻璃、空心玻璃、饰面版和隔声隔热的泡沫玻璃。
电真空玻璃和照明玻璃:电子管、电视机、电灯。
光学玻璃:显微镜、望远镜、照相机、光谱仪和光学仪器电影放映机、眼镜片。
玻璃化学仪器、温度计:
玻璃纤维、玻璃棉:电绝缘工业、化工过滤和隔热、隔声、耐蚀的优良材料。。
新品种玻璃:感光照相和印刷制版玻璃;耐热性好、硬度大、强度高的微晶玻璃;高折射率、低散射或低折射、高散射的光学玻璃;透紫外线和透红外线玻璃。
玻璃的发展历史
五千年前:埃及人,泥罐熔融,捏制或压制,饰物或简单器皿。
公元前一世纪:罗马人,铁管吹制。
十一世纪到十五世纪:威尼斯,穆兰诺岛,窗玻璃、瓶玻璃、玻璃镜和装饰玻璃。
十六世纪:制造技术得到传播。
十七世纪时:煤代替木柴燃料。
1790年:狄南(Guinand),搅拌法生产光学玻璃。
十八世纪后期:路布兰制碱法,发生炉煤气和蓄热室池炉,氨法制碱和耐火材料。
十九世纪末:阿贝(Abbe)和肖特(Schott)对光学玻璃进行了系统研究。
二十世纪:专门学科。
东周时期:玻璃珠、玻璃壁,氧化铅和氧化钡。
旧中国:手工生产,设备简陋、生产条件很差,玻璃品种也不多。
解放后:生产、科研和技术力量的培养。
18世纪:冠形制板法和圆桶法。
19世纪末:Sieverts法,Lubers。
20世纪初:Fourcault的有槽垂直引上法,Colburn的平拉法,Pittsburgh的无槽垂直引上法,Hitchcook和Heal浮法玻璃生产雏形。
20世纪50年代:英国Pilkington兄弟,浮法玻璃。
二、浮法玻璃技术的发展概况
1.国外浮法玻璃生产概况
2003年底,36个国家,140条浮法,3亿吨,80%以上。
0.5~5mm,拉引规模在150~1000t/d。
日本旭硝子21%,英国Pilkington为12%,美国PPG为11%,法国圣戈班11%,美国加迪安公司为9%。旭硝子公司37条生产线,资产158亿美元,销售额67亿美元。
2.国内浮法玻璃工业发展现状
1965年开始实验室试验,到1971年生产性实验线建成。1981年, “洛阳浮法”。
2003年,98条,“洛阳浮法” 80余条,拉引量300~700吨,1.1~25mm,2.13亿重箱/年。
3.浮法玻璃的新技术、新产品发展趋势
(1)浮法玻璃生产技术方面
超薄技术:
在线镀膜技术:
浮法玻璃退火窑辊道技术:
一窑多线:
计算机模拟技术在玻璃工业中的应用:
节能工艺技术:
环保技术:
(2)发展新品种方面
利用太阳能发电的平板玻璃:
电致变色玻璃:
光致变色玻璃:
自洁净玻璃:
信息产业玻璃:
计算机硬盘用玻璃基板:
折光;防静电抗电磁波干扰;天线玻;蓄光;防盗。
第一章 玻璃结构(structure of glass)
(一)玻璃及玻璃态 (glass & glass state)
1.狭义的玻璃
由熔融物冷却而不析晶得到的无机物
三条件: 非晶体 熔融物冷却 无机物
2.广义的玻璃(玻璃态)
表现出玻璃转变现象的非晶态物质
转变现象:Tg=1/2~2/3Tm性质突变(比热、等)
(二)玻璃发展简史 (brief history)
泥罐熔融 铁管吹制 威尼斯 煤代木
搅拌法 蓄热室
(三)玻璃的分类 (classification)
日用玻璃(器皿、平板、瓶罐等)
特种玻璃(光纤、生物玻璃等)
(四)玻璃化方法 (glassification method)
1.固体(晶体)直接玻璃化——无定形固体
2.经液相玻璃化——玻璃
3.由气相制玻璃——无定形薄膜
(五)玻璃态物质的特性 (property)
1.各向同性(isotropy)
质点无序排列而呈统计均匀结构的外在表现
2.亚稳性(metastability)
所有玻璃都有析晶倾向
3.无固定熔点(unfixed melting point)
4.可逆性(reversibility)
温变过程中性质产生逐渐连续的变化且可逆
5.可变性(changebility)
性质随成分(一定范围)发生连续和逐渐的变化
(六)玻璃的结构学说 (Structure theories of glass)
一、传统学说
1.过冷液体学说(Tamman)
不同分子混合物
2.聚合物学说(Sockman)
高分子聚集体 [SixO3x+1]-2(X+1)
3.无规则网络学说* (W.H.Zachariasen 1932年)
基本观点 [SiO4]是基本结构单元
三维空间作无序排列, R+ R2+填充在网络空隙
实验证实:Warren X-ray结构分析数据
学说重点:多面体排列的连续性、均匀性和无序性
4 .晶子学说(列别捷夫)
基本观点:玻璃有无数晶子组成
晶子有晶格畸变,晶子到无定形介质是渐变
实验证实:X-ray结构分析数据
学说重点:玻璃的有序性、不均匀性和不连续性
玻璃态物质结构特点: 短程有序(微观)
长程无序(宏观)
二、玻璃结构新学说
体系模型(保加利亚 I•B Goguv)
理论要点:五种有序区域,不同系统中,各种有序区有不同比例。
电子有序(化学键是结构单元)
短程有序(多面体是结构单元)
分子有序(有一定化学组成,可用分子式表示)
簇有序 (多氧四面体聚合体是结构单元)
相有序 (多相存在)
(七)玻璃的结构分析(structure analysis)
一、性质与其反映的结构情况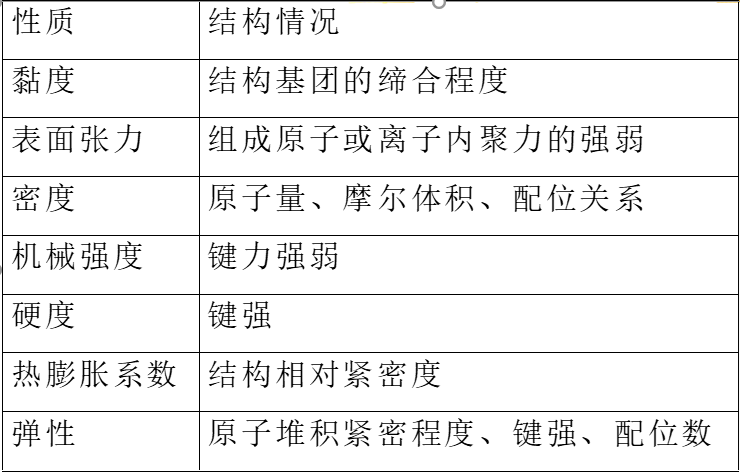
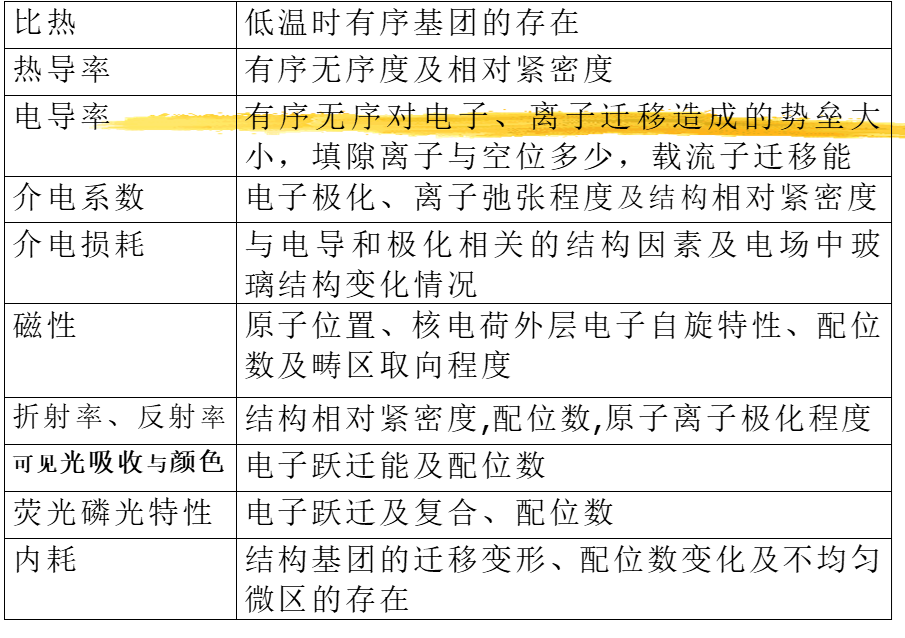
二、结构分析方法与反映的结构信息
结构分析方法:衍射法、电镜法、光谱法

(八)玻璃熔体的结构(structure of glassmelt)
一、硅酸盐熔体的结构
1.熔体中有许多聚合程度不同的负离子团平衡共存
2.负离子团形状不规则,短程有序
3.负离子团的种类、大小随熔体组成及温度变化而变化。
4.离子半径大而电荷小的的氧化物可使硅氧集团断裂出现,负离子团变小;
5.硅酸盐熔体中的分相现象是普遍的
聚合反应
M2[SiO4] +Mn+1 [SinO3n+1] = Mn+2 [Sin+1O3n+4 ]+MO
二、玻璃结构与熔体结构的关系
1继承性
2结构对应性
(九)单元系统氧化物玻璃结构
一、石英玻璃
1.硅氧键与硅氧四面体
(1) Si原子基态 3S2 3P2
O原子基态 2S2 2P4
Si原子SP3杂化后与 O原子SP杂化后键合
Si-O-Si键含 键和p-d 键
(2)硅氧四面体特性
Si原子四个杂化轨道与四面体构型一致
• 四个Si-O键中键成分相同
• Si-O键是极性共价键 (52%)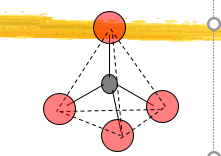
• Si-O-Si键角120°~180°
Si-Si距离可变(结构无序原因)
• 无极性
• 键强较大 (106千卡/摩尔)
• 四面体间以顶角相连

2.石英玻璃的结构模型
(1)[SiO4]是基本结构单元 架状结构
(2)键能大、分布均
3.石英玻璃特性
·高软化点 ·高粘度
·膨胀系数小 ·机械强度高
·化稳性好 ·透紫外、红外线好
·结构开放 高压透气 d=2.1~2.2 g/cm3
二、B2O3玻璃
1、B-O键与[BO3]
(1)硼原子基态 2S22P1
SP2杂化轨道呈平面正三角指向
B与O形成 P-P键
(2) [BO3]特性
· B-O-B键角可变 ·键强119千卡/摩尔
· [BO3]可连成三元环
2. B2O3玻璃结构模型
(1) [BO3]或硼氧环构成层状结构,层间以范德华力或键相连
(2)键角可有较大改变
(3)结构随温度升高向链状变化
3. B2O3玻璃性质
(1)对比
B2O3 SiO2
·键能 119千卡/摩尔 106千卡/摩尔
·结构 二维层状 三维架状
·单元 [BO3] [SiO4]
·对称性 不对称 对称
·屏蔽 三个氧 四个氧
(2)性质
软化点低450C、化稳性差、膨胀系数大
无实用价值
三、P2O5玻璃
1.结构特征
(1)结构单元 [PO4] P-O-P键角140°
(2) [PO4] 中有一个带双键的氧,是结构的不对称中心
(3)层状结构,层间为范德华力
2. P2O5玻璃性质
粘度小、吸湿性强、化稳性差
无实用价值
(十)硅酸盐玻璃结构
一、碱硅酸盐系统
1.结构
(1)多种阴离子团共存
(2)R+处于网络空隙,平衡电荷
2.性质
较石英玻璃变差(结构完整性、对称性被破坏)
无实用价值
二、钠钙硅系统
性质比碱硅系统明显变好。
Ca2+的积聚作用使网络加强
积聚作用:高场强的网络外体使周围网络中的氧按其本身的配位数来排列。
离子势 Z/r Ca2+: 2/0.99
Na+: 1/0.95
• Ca2+的压制作用:牵制Na+的迁移,使化稳
电导率
Ca2+为网络外体
• 钠钙硅系统是日用玻璃的基础
三、铅硅酸盐玻璃
1. Pb2+的特性
电子构型: 5S25P65d106S2
18+2电子构型 电子云易变形
2. 二元铅硅酸盐玻璃结构
(1)PbO浓度小 似Na2O做网络外体
(2)PbO浓度大 以[PbO4]四方锥进入网络
Pb处于锥顶,惰性电子被推向一边
[PbO4]与[SiO4]共顶或共边相连成链状
(3)铅玻璃中的金属桥
金属桥 

其中1/2Pb0为金属桥




【推荐】编程新体验,更懂你的AI,立即体验豆包MarsCode编程助手
【推荐】凌霞软件回馈社区,博客园 & 1Panel & Halo 联合会员上线
【推荐】抖音旗下AI助手豆包,你的智能百科全书,全免费不限次数
【推荐】博客园社区专享云产品让利特惠,阿里云新客6.5折上折
【推荐】轻量又高性能的 SSH 工具 IShell:AI 加持,快人一步