化学学习笔记
酸 \(+\) 金属 \(\rightarrow\) 盐 \(+ \text{H}_2 \uparrow\)
酸 \(+\) 金属氧化物 \(\rightarrow\) 盐 \(+\) 水
酸 \(+\) 盐 \(\rightarrow\) 新酸 \(+\) 新盐
碱 \(+\) 盐 \(\rightarrow\) 新碱 \(+\) 新盐
酸 \(+\) 碱 \(\rightarrow\) 盐 \(+\) 水
盐 \(+\) 盐 \(\rightarrow\) 盐 \(+\) 盐
以上除第一个外,皆为复分解反应(离子反应)。
如何判断一个复分解反应发不发生?生成物为沉淀、气体或弱电解质。中和反应可以不在溶液中发生,其余都得在溶液体系中发生(e.g. 盐得溶于酸)。
我猜测啊,上面的本质就是生成物不能和反应物一样,生成物之间不能反应。
搜到的几个优先原则:
-
金属 \(+\) 酸,活泼的金属先反应。
-
金属 \(+\) 盐溶液,活动性差距最大的先置换。
-
酸、碱、盐混合时,酸碱中和最优先。
举例:\(\text{HCl}\)、\(\text{NaOH}\)、\(\text{Na}_2\text{CO}_3\)
假设 \(\text{HCl}\) 先与 \(\text{Na}_2\text{CO}_3\) 反应,生成 \(\text{CO}_2\)、 \(\text{H}_2\text{O}\)、 \(\text{NaCl}\);然后 \(\text{CO}_2\) 与 \(\text{NaOH}\) 反应,生成 \(\text{Na}_2\text{CO}_3\),回到原点。(没太搞懂?)
又好像 \(\text{Ba}^{2+}\) 是例外?
-
pH 值差距越大的越先反应。
-
碳酸盐 \(+\) 混合溶液,“气体”优于“沉淀”。
-
金属、金属氧化物与酸反应,金属反应物优于金属与酸反应。
钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金
\(\text{K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au}\)
挥发性:\(\text{H}_2\text{CO}_3\)、\(\text{HCl}\)、\(\text{HNO}_3\)、\(\text{NH}_4\text{OH}\)
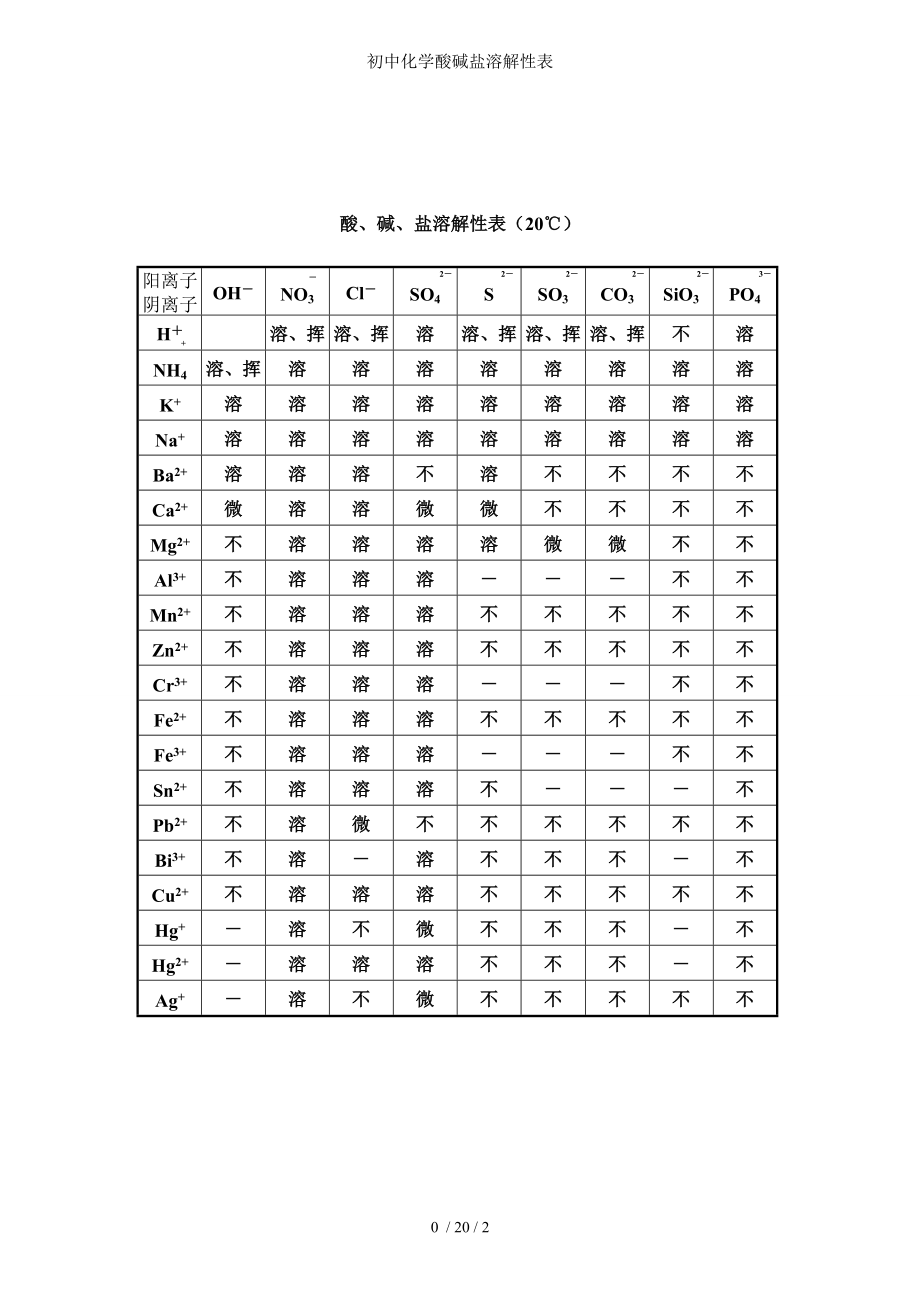
\(\text{CO}_3^{2-}\):(溶)钾、钠、铵、氢
\(\text{Cl}^-\):(不溶)银
\(\text{SO}_4^{2-}\):(不溶)钡
\(\text{OH}^-\):(溶)钾、钠、铵、钡
\(\text{NO}_3^-\):全溶